Verordnung (EU) 2021/2282
Artikel 7 (1) der Verordnung (EU) 2021/2282 spezifiziert, wann eine Gesundheitstechnologie einer Gemeinsamen Klinischen Bewertung (Joint Clinical Assessment, JCA) unterzogen werden muss. Dabei spezifiziert Absatz 1a, dass der Zeitpunkt der initialen Marktzulassung entscheidend ist. Nur wenn diese nach den in Artikel 7 (2) genannten Fristen (Onkologika und ATMPs: 12. Januar 2025, Orphan Drugs: 13. Januar 2028, alle weiteren Produkte: 13. Januar 2030) eingereicht wird, wird für die neue Gesundheitstechnologie ein JCA durchgeführt. In Artikel 7 1b wird weiterhin spezifiziert, dass Indikationserweiterungen bereits bestehender Zulassungen nur dann einem JCA unterzogen werden, wenn die Gesundheitstechnologie zuvor bereits innerhalb eines JCAs bewertet wurde. Indikationserweiterungen von Gesundheitstechnologien, die initial auf nationaler Ebene bewertet wurden, verbleiben weiterhin auf nationaler Ebene. Es wird also eine parallele Existenz beider Verfahren erwartet (Abbildung 1).
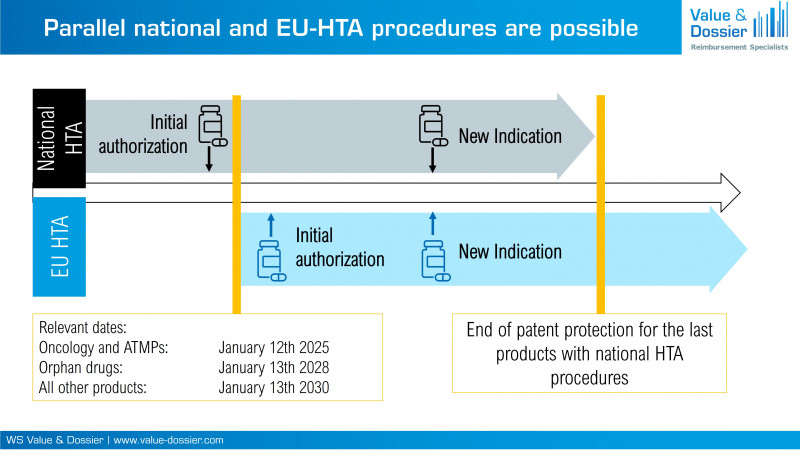
Abbildung 1: Nationale und EU-HTA Verfahren werden auch nach den relevanten Daten parallel existieren.
Konsequenzen für pharmazeutische Unternehmen
Indikationserweiterungen unterschiedlicher Gesundheitstechnologien könnten in Zukunft zum gleichen Zeitpunkt innerhalb verschiedener Verfahren (national vs. EU) bewertet werden. Aus Sicht des pharmazeutischen Unternehmers wird auf die Konsistenz der nationalen und europäischen Bewertungen zu achten sein. Insbesondere für Produkte mit geplanter Einreichung zur Marktzulassung im Zeitraum des jeweiligen Stichtages sollte erwogen werden, ob eine frühe Einreichung vor dem jeweiligen Stichtag (Folge: nationale Bewertung aller Indikationserweiterungen) oder eine spätere Einreichung (Folge: JCA aller Indiktionserweiterungen) strategisch sinnvoller ist.
Konsequenzen für die Bewertung des Zusatznutzens
Gemäß Regulation (EU) 2021/2282 soll der JCA-Report keine abschließende Bewertung des Zusatznutzens beinhalten, da diese in der Autorität der Mitgliedsstaaten liegt. Es ist jedoch nicht auszuschließen, dass die Entscheidung der Mitgliedsstaaten durch die zusätzliche, im EU-HTA zur Verfügung gestellte Information positiv oder negativ beeinflusst werden können. Die Konsequenz wäre eine positive bzw. negative Verzerrung der Ergebnisse zum Zusatznutzen im Vergleich zu rein nationalen Verfahren führen. Um Vor- oder Nachteile von Produkten des europäischen Verfahrens gegenüber den Produkten des nationalen Verfahrens zu vermeiden, muss sichergestellt werden, dass beide Verfahren bei gleichartiger Evidenzlage zum gleichen Ergebnis führen. Um dies zu gewährleisten sind vor allem die nationalen HTA-Behörden in der Verantwortung.
Ein Fallbeispiel
- PICO #1: Vergleich zu Komparator A ➜ statistisch signifikanten Vorteil
- PICO #2: Vergleich zu Komparator B ➜ keine statistisch signifikanten Unterschiede
- Mitgliedsstaat #1 fordert PICO #1 ➜ Positive Bewertung wird erwartet, da das Produkt einen statistisch signifikanten Vorteil gegenüber Komparator A zeigt
- Mitgliedsstaat #2 fordert PICO #2 ➜ Ein negatives Ergebnis wird erwartet, da im Vergleich zu Komparator B keine Überlegenheit gezeigt werden kann
- Mitgliedsstaat #3 gibt die Möglichkeit zur Auswahl zwischen PICO #1 und PICO #2 ➜ Strategische Entscheidung, einen Vergleich mit Komparator A zu präsentieren, da hier statistisch signifikante Vorteile gezeigt werden können.
- Mitgliedsstaat #1 sieht PICO #1 als relevant an ➜ Positive Bewertung wird erwartet
- Mitgliedsstaat #2 sieht PICO #2 mit Komparator B als relevant an ➜ Negative Bewertung wird erwartet. Ist jedoch eine positive Beeinflussung des Ergebnisses möglich, wenn der Vergleich mit Komparator A als Argument angebracht wird, und könnte dies zu einem Vorteil gegenüber rein nationalen Verfahren führen?
- Mitgliedsstaat #3 sieht sowohl PICO #1 als auch PICO #2 als relevant an ➜ Was passiert, wenn mehrere relevante PICOs unterschiedliche Ergebnisse zum Zusatznutzen zeigen? Kann sich das Ergebnis von PICO #2 negativ auf den Erstattungsbetrag auswirken und könnte dies zu einer Benachteiligung im Vergleich zu rein nationalen Verfahren führen?