Seit Anfang 2025 arbeiten die Mitgliedstaaten des Europäischen Wirtschaftsraums (EWR) an gemeinsamen klinischen Bewertungen (Joint Clinical Assessments, JCA) neuer Arzneimittel. Kürzlich wurden die ersten neun JCAs bekannt gegeben, in denen zwei Arzneimittel für neuartige Therapien (ATMPs) und sieben Onkologika bewertet werden.
Deutschland, Frankreich und Irland gehören derzeit zu den aktivsten HTA-Behörden. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) ist an vier onkologischen Bewertungen beteiligt: an drei als Gutachter und an einer als Co-Gutachter. Der erste Bericht ist bereits fertiggestellt und wird voraussichtlich Anfang 2026 veröffentlicht. Ende November wird zudem das Jahresarbeitsprogramm für 2026 erwartet, in dem die geplante Anzahl der gemeinsamen wissenschaftlichen Konsultationen (JSC) und JCAs sowie die Bewerbungsfristen für JSCs veröffentlicht werden.
Nach ihrer Fertigstellung werden die JCAs von allen EWR-Staaten, also allen EU-Mitgliedstaaten sowie Norwegen, Island und Liechtenstein, als Grundlage für nationale Nutzenbewertungen verwendet werden – eine bedeutende Veränderung in der Art und Weise, wie Evidenz in Europa bewertet wird.
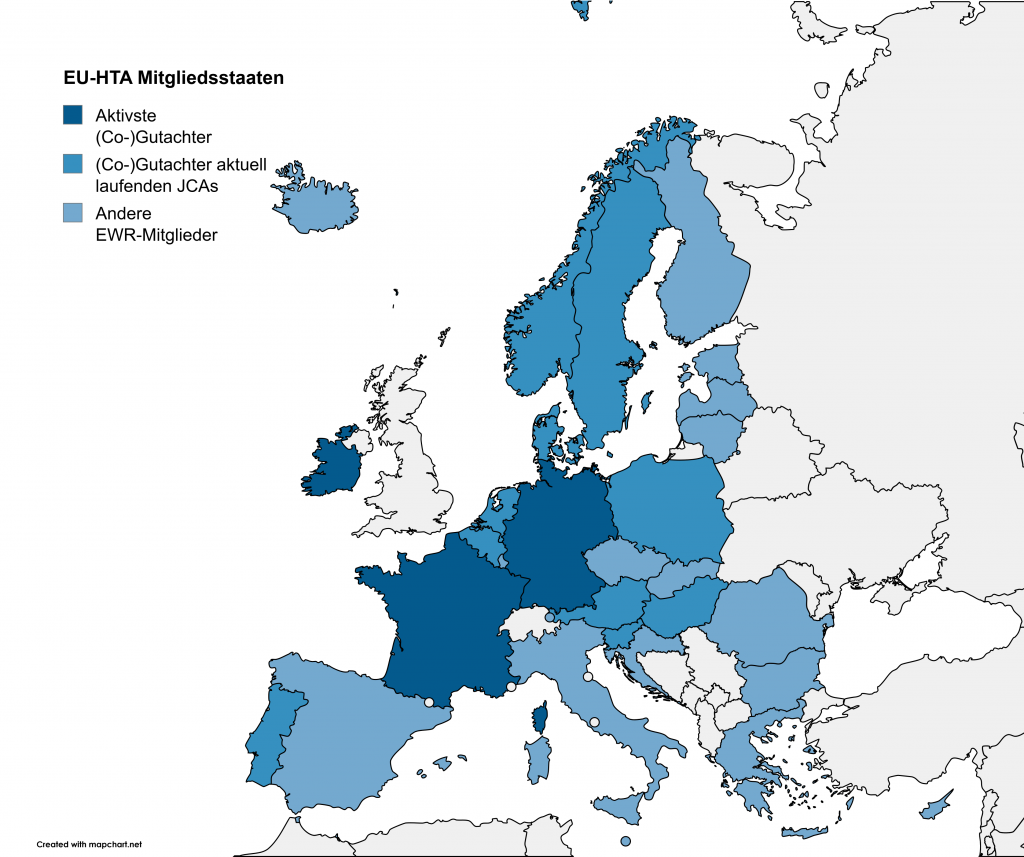
Abbildung 1: Mitgliedsstaaten des EU-HTA. (Co-)Gutachter von laufenden JCA-Prozessen sind farblich hervorgehoben.
Die HTA-Koordinierungsgruppe (HTACG) ist das wichtigste Verwaltungsgremium, das für die Umsetzung der EU-Verordnung zuständig ist. Sie umfasst vier Untergruppen, die sich gezielt mit JCAs, JSCs, der Identifizierung neuer Gesundheitstechnologien und Methodik befassen. Sie bestehen aus Vertretern der Mitgliedstaaten und stehen in engem Kontakt mit dem HTA-Stakeholder-Netzwerk, dem Patientenverbände, Nichtregierungsorganisationen und Entwickler von Gesundheitstechnologien sowie Gesundheitsexperten angehören. Die administrative, technische und IT-Unterstützung für Pharmaunternehmen und andere Interessengruppen wird vom HTA-Sekretariat der Europäischen Kommission bereitgestellt.
Um die Umsetzung von EU-HTA weiter zu unterstützen, hat die HTACG ein Webinar veröffentlicht, in dem das JCA-Verfahren ausführlich erläutert wird, sowie Anleitungen zur Nutzung der HTA-IT-Plattform. Das Webinar enthält auch aktuelle Informationen und Erkenntnisse aus den derzeit laufenden Verfahren sowie Abschnitte, in denen Fragen der Teilnehmenden beantwortet werden. Daher ist es eine hilfreiche Ressource für alle Interessengruppen, die sich auf den neuen europäischen HTA-Rahmen vorbereiten. Alle von der HTACG veröffentlichten Informationen finden Sie hier:
Der neue EU-HTA-Prozess nimmt also langsam Form an. Diese ersten gemeinsamen Bewertungen markieren den Beginn einer neuen Ära der Bewertung neuer Arzneimittel in Europa. Durch den Austausch von Fachwissen und die Angleichung von Methoden wollen die EU-Mitgliedstaaten und die EWR-Länder die Bewertung von Gesundheitstechnologien einheitlicher, transparenter und effizienter gestalten und damit die Voraussetzungen für künftige Zusammenarbeit und Innovation schaffen. Das neue Verfahren birgt viel Potenzial, bringt aber auch Herausforderungen und Schwierigkeiten mit sich. Die Fristen für Pharmaunternehmen sind knapp und die Anforderungen komplex. Eine gute Vorbereitung und fachkundige Beratung sind entscheidend für eine erfolgreiche Umsetzung.
